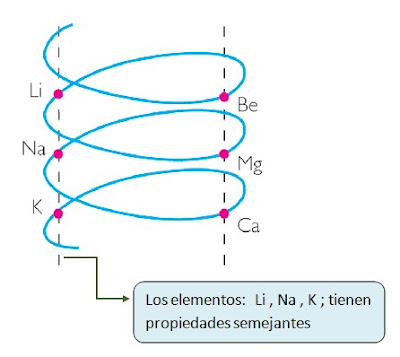
2.0 LA TABLA PERIÓDICA ACTUAL (RELACIÓN ESTRUCTURA ELECTRÓNICA Y REACTIVIDAD)
En 1913 Moseley ordeno los elementos de la tabla periódica usando como
criterio de clasificación el número atómico. Enuncio "la ley
periódica": "si los elementos se colocan según aumenta su número
atómico, se observa una variación periódica de sus propiedades físicas y
químicas".
A partir de entonces la clasificación periódica de los elementos siguió
ese criterio, pues en los átomos neutros el número de protones es igual al de
electrones y existe una variación directa entre el ultimo orbital ocupado por
un -e de un átomo (configuración electrónica y su posición en la tabla
periódica y, por tanto en su reactividad química, formula estequiometrica de
compuestos.
Se clasifican en cuatro bloques:
- Bloque s: A la izquierda de la
tabla, formado por los grupos 1 y 2.
- Bloque p: A la derecha de la tabla,
formado por los grupos 13 al 18.
- Bloque d: En el centro de la tabla,
formado por los grupos 3 al 12.
- Bloque f: En la parte inferior
de la tabla.


Comentarios
Publicar un comentario